目的:採取した自由なサンプルを中和・沈殿・キレート滴定等により分析し、考察する。 実験方法: ① 色・におい・濁りなどを確認した。 ② 各溶液のpHを調べた。 ③ 各水溶液少量に硝酸銀水溶液を数滴滴下し、沈殿の量を確認した。 ④1 容量分析用標準液 キレート滴定では、標準液として下記のものが用いられる。 EDTAは、1分子内に4個のカルボキシ基と2個の窒素原子を配位原子にもつ六座配位子であり、金属イオンと1:1で結合し、安定なキレートを形成する。 EDTA液を金属イオンを含む医薬品に滴下すると、1:1で結合し、安定なキレートを形成することから、金属イオンを含む医薬品の定量が17種の水を試料とし、キレート滴定法を行い、硬度とCa2、Mg2の量を決定した。その結果を表1に示す。 表1 様々な水の分析結果 ★考察★ A~Cの結果から、やはり硬度には大きな差があることが分かった。
水の硬度測定
キレート滴定 カルシウム 考察
キレート滴定 カルシウム 考察-実験問題2 キレート滴定とヨウ素還元滴定による 金属イオンの定量 (18 5 27, IChO50代表生徒強化訓練合宿@長崎大学) キレート滴定(錯滴定)とヨウ素還元滴定は,溶液中の金属イオンの定量方法として,代表的 な方法である。<化学>キレート滴定関連で質問です。 滴下する溶液に、kohを加えるのですが、phを高くする為に使用する。という事ですが、どんな作用で何でその必要があるんですか? また遮蔽剤とは何のことでしょう? 化学的理



キレート滴定
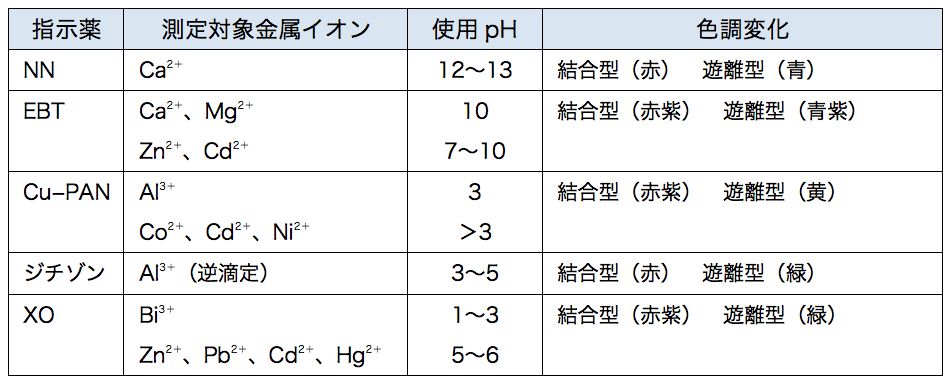
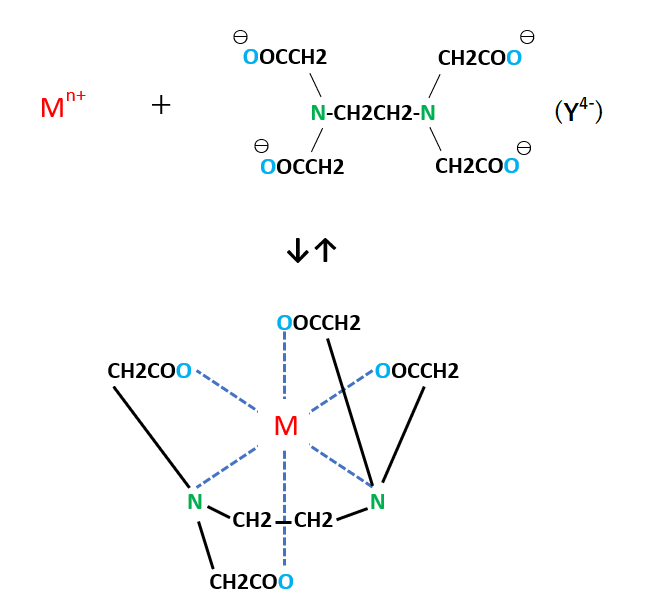
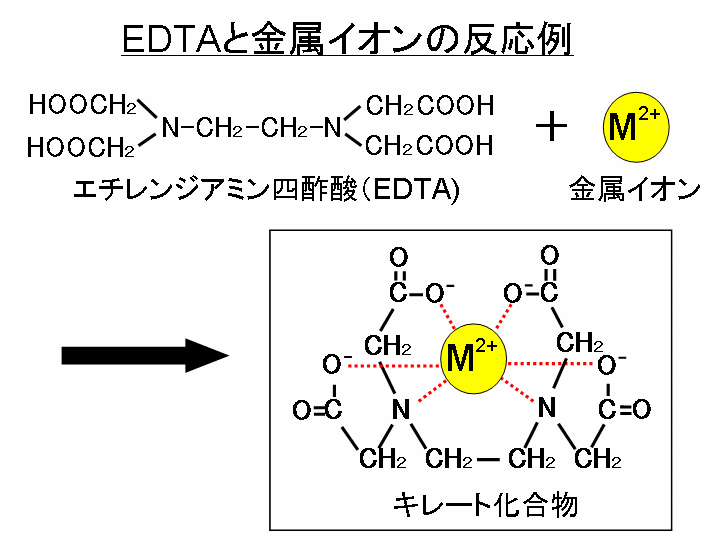
キレート滴定に汎用されるキレート試薬;EDTA(六座配位子) ethylenediaminetetraacetic acid エチレンジアミン四酢酸 >NCH 2CH 2N< CH 2 COOH HOOCH C CH 2 COOH HOOCH C EDTAと金属との反応比は1:1 試薬としては 2Na塩を入手 M Y MY K MY = MY/MY キレート生成定数となる。 キレート滴定では、この至適 pH を保つために緩衝液が用いられる! XIII13 補助錯化剤 一般にキレート滴定はかなり高い pH で行なうが、このとき金属水酸化物を沈殿させな いように、 EDTA より Kf の小さい錯化剤(=補助錯化剤 )を共存させることがキレート滴定は、中和滴定などのようなイオン反応とは異なり反応が遅 いので、終点近くでは特に1 滴あるいは半滴ずつ滴下し、色の変化に注意 せよ。同様の滴定を3 回以上行う。 各実験台毎に各種滴定法で必要な器具・試薬を配布します。
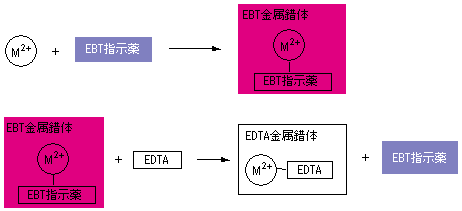
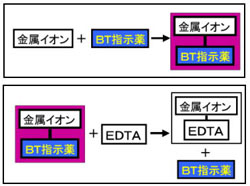
して酸性領域でedta によるキレート滴定によって定量します。引き続き、鉄(Ⅱ)イオンをペ ルオキソ二硫酸アンモニウムを用いてすべての鉄(Ⅱ)イオンを鉄(Ⅲ)イオンに酸化したのち、 前記同様にedta によるキレート滴定によって定量します。 3 feそこで、滴定の終点を見えるようにするため、 ebt(エリオクロムブラックt) などの指示薬を使用します。ebtを指示薬とした場合、 赤 → 青 となった時点を終点とできます ebtもキレート剤として働き、ca、mgなどと錯体を形成した際、赤色を示します。キレート滴定 濃度既知のca 0005m ca2溶液による水道水、ミネラルウォーターの硬度決定 実験日 5月9日金曜日 実験場所 1352材料設計学学生実験室 実験環境 天気:快晴 気温:8℃ 湿度:28% 目的 キレート滴定(edta法)により、edta溶液の濃度を決定し、edta法を用いて水道水、ミネラル
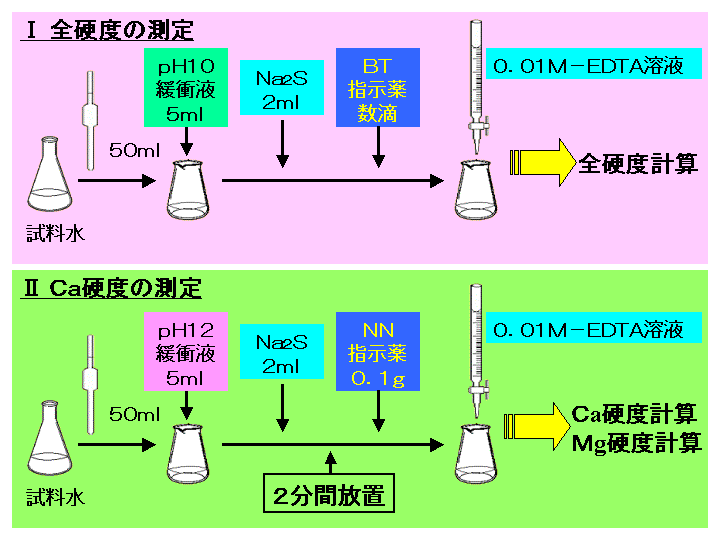
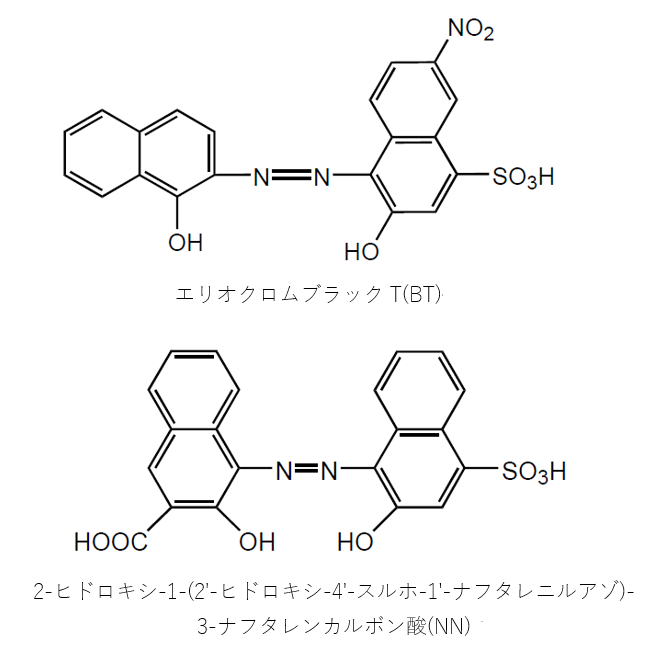
キレート滴定における終点の検出 金属指示薬:金属イオンの濃度変化により鋭敏に変色 (指示薬も金属イオンとキレートを形成する) エリオクロムブラックt (ebt) n n oh oh so 3 h no 2 h3in 2 ph 変化に伴うebt 指示薬の色調変化 n n oh oh so 3 h no 2 h3in pka1=16 pka2=63従って、キレート滴定に使用する場合、溶解後直ちに滴定する必要がある。 実際には、JIS K8001の指示薬の項にも記載されているように、本品をK 2 SO 4 で粉砕希釈して使用する(希釈率1:0で、NN diluted with potassium sulfateの商品名で販売)。キレート滴定 1.目的 キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。



無料印刷可能 酸化 還元 滴定 考察 画像ブログ



1 3キレート滴定 亜鉛 Ii Edta 塩化銅 Ii Edta のキレート滴定法を学ぶ
33.キレート滴定 キレート滴定では、金属イオンとキレート試薬(もっぱらedtaが使われる)が安定な錯体を作ることを利用する。 したがって、たとえば ebt の場合は滴定の終点として、完全に赤みの消えたところを取る。 キレート滴定では、ph の設定にNn指示薬 キレート滴定の指示薬(錯形成→ 赤:遊離→ 青) edta溶液 滴定剤 有機廃液タンクへ (注ぎ口にろ紙をつけておくこと!) 実験の注意事項 edta滴下 (1) 『ホールピペットで取る』と指定が無いものは大体でok!キレート滴定法を実際試料の分析に応用する場合,そ の成否を左右する最も大きな要素は,滴 定の選択性をい かにして高めるかにあるといっても過言ではないな ぜ なら,edtaを 用いるキレート滴定法は,金 属イオン


マイクロスケール化 今までビュレットを用い キレート滴定法で硬度を判断していた 今回は ビュレットを用いず簡易的に硬度を測定する方法を開発し マイクロスケール化をすることで 子ども達にも安易に実験ができるようにする 準備物 材料


マイクロスケール化 今までビュレットを用い キレート滴定法で硬度を判断していた 今回は ビュレットを用いず簡易的に硬度を測定する方法を開発し マイクロスケール化をすることで 子ども達にも安易に実験ができるようにする 準備物 材料
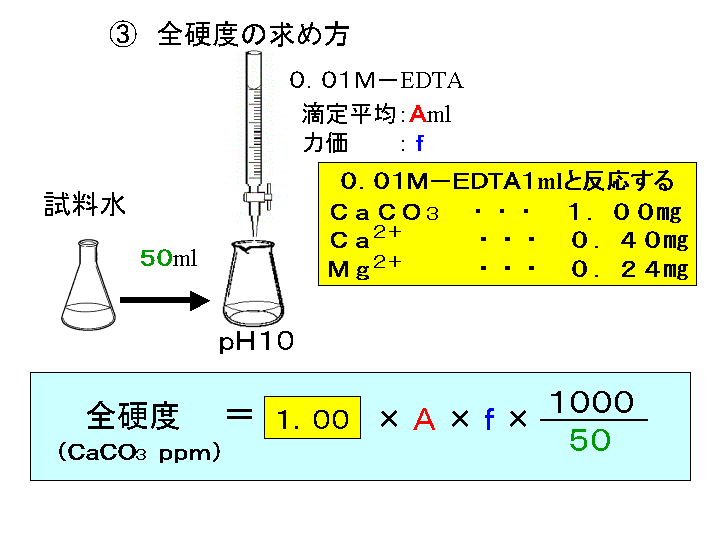
硬 度 = EDTAの滴定量 × 1000/試料100ml (硬度は1リットル中の量として表すため1000をかける) 解説 この実験では金属イオンにEDTAを加え、金属キレート化合物を生成させ、それをEBTのような金属指示薬で滴定しています。して酸性領域でedta によるキレート滴定によって定量します。引き続き、鉄(Ⅱ)イオンをペ ルオキソ二硫酸アンモニウムを用いてすべての鉄(Ⅱ)イオンを鉄(Ⅲ)イオンに酸化したのち、 前記同様にedta によるキレート滴定によって定量します。 3 feキレート 滴定法で土壌中のカルシウム濃度が簡便に測定する ことが確認できたので,今後サンプル数を増やして データを取得していきたい。 3.結論 ①本実験では二酸化炭素を添加した水への炭酸カル シウムの溶解度が大きくなることがキレート滴定に


水の硬度測定 キレート滴定


水の硬度測定 キレート滴定
キレート滴定における終点の検出 金属指示薬:金属イオンの濃度変化により鋭敏に変色 (指示薬も金属イオンとキレートを形成する) エリオクロムブラックt (ebt) n n oh oh so 3 h no 2 h3in 2 ph 変化に伴うebt 指示薬の色調変化 n n oh oh so 3 h no 2 h3in pka1=16 pka2=63となる。 キレート滴定では、この至適 pH を保つために緩衝液が用いられる! XIII13 補助錯化剤 一般にキレート滴定はかなり高い pH で行なうが、このとき金属水酸化物を沈殿させな いように、 EDTA より Kf の小さい錯化剤(=補助錯化剤 )を共存させることが キレート滴定は,G, Schwarzenbach(シュヴァルツェ ンバッ ハ)らによって確立されたエチ レンジア ミン四酢酸


無料印刷可能 酸化 還元 滴定 考察 画像ブログ



キレート滴定
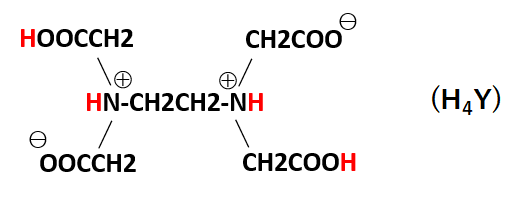
4.キレート滴定 41 001Medta標準溶液の調製 要点 キレート滴定において標準溶液として用いられるedtaは、普通edtaの2ナトリウム 塩h2na2y・2h2oでetaと表示されている。この試薬は結晶水以外に多少の水分を含んでEDTA(エチレンジアミン四酢酸)は、最大6本の腕(6座配位)で2価~4価の金属イオンと、そのイオンの価数に関係なく1:1で結合し、安定なキレート化合物を生成する。 この反応を利用した金属イオンの定量法をキレート滴定法という。 (キレートとはカニのはさみの意味) なお、EDTAは水にほとんど溶けないため、キレート滴定では水に溶けやすいEDTA・2Naを用いる


指示薬 Japaneseclass Jp



ダウンロード可能 キレート滴定 考察 人気のある画像を投稿する


キレート滴定で質問聞いて下さい 丸矢印のところがわかりません 教え Yahoo 知恵袋



ダウンロード可能 キレート滴定 考察 人気のある画像を投稿する



加藤 航希 Gydbtflajs4xyaf Twitter


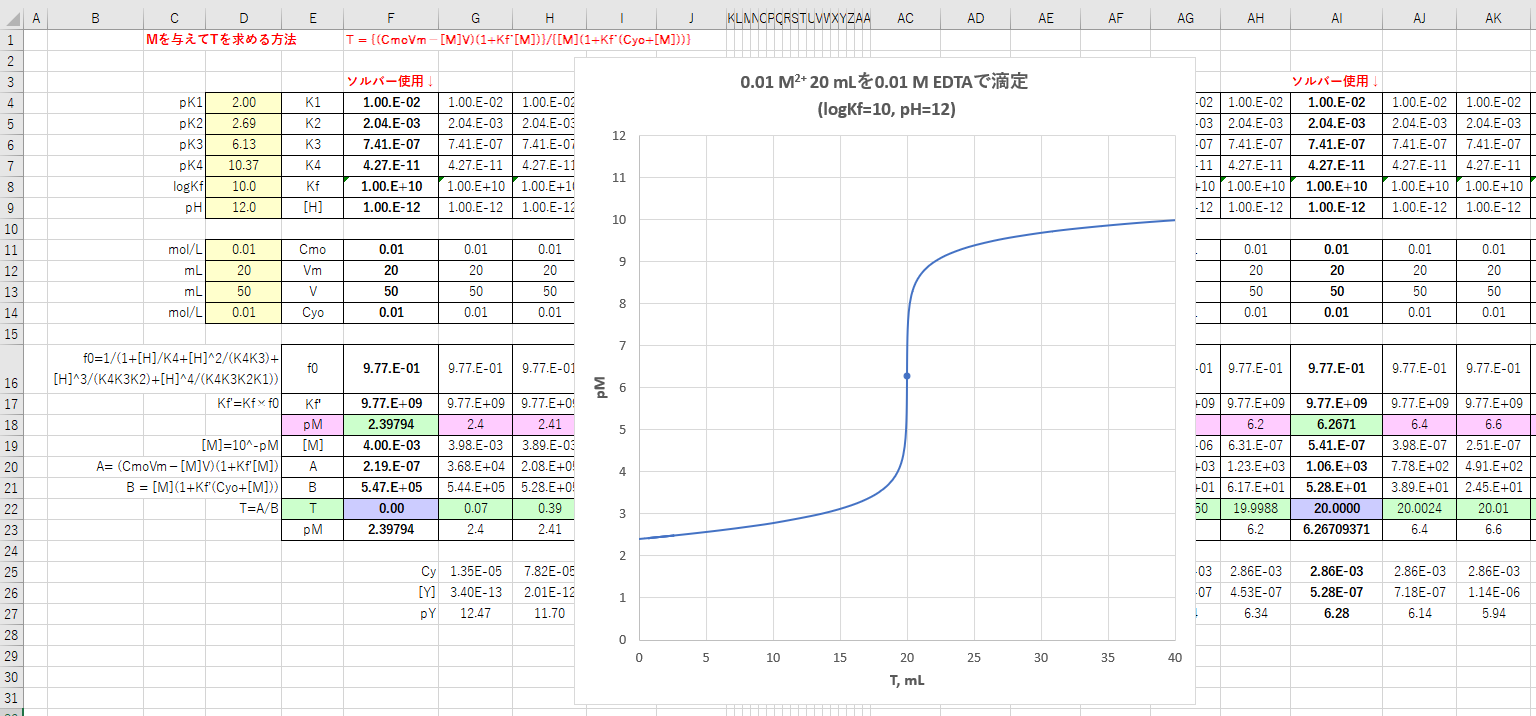
Edta滴定の基礎 滴定曲線 溶解度などーエクセルを用いて


化学キレート滴定の問題です 赤線引いたところの意味がわかりません Yahoo 知恵袋



水の硬度測定


水の硬度測定 キレート滴定


画像あり 水の全硬度を求める公式の導出方法を教えてください 0 0 Yahoo 知恵袋


水の硬度測定 キレート滴定



大学の 水の分析実験 なんとなく実験しています



水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog



水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog


Edta滴定の基礎 滴定曲線 溶解度などーエクセルを用いて



Microsoft Word 化学実験 工 先進工 共通 テキスト 第2qから変更あり Docx Pdf 無料ダウンロード


Edtaの濃度の求め方について キレート滴定についての知識が Yahoo 知恵袋



水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog


ダウンロード可能 キレート滴定 考察 人気のある画像を投稿する


Edta滴定の基礎 滴定曲線 溶解度などーエクセルを用いて



滴定法の入門 臨床検査 4巻3号 医書 Jp


Edta 滴定曲線 溶解度などーエクセルを用いて
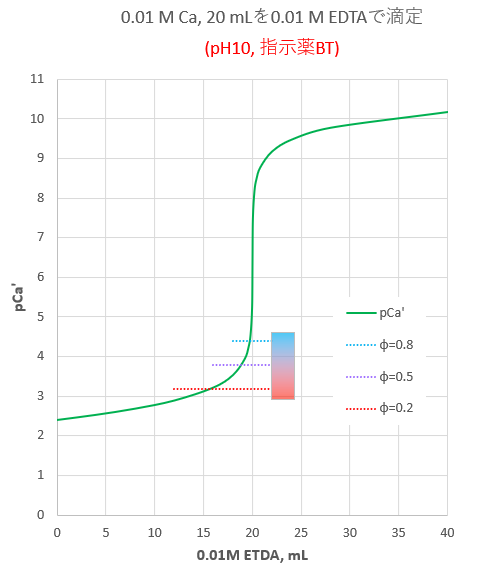


Edta 滴定曲線 溶解度などーエクセルを用いて



ダウンロード可能 キレート滴定 考察 人気のある画像を投稿する


水の分析


大学でキレート滴定を行い 水道のca の濃度とedta標準液の濃度だけで理 Yahoo 知恵袋


2cのページ



キレート滴定 資料検索 資料 全ての資料 全ての種類 関連順 詳細リスト ハッピーキャンパス



キレート滴定 資料検索 資料 全ての資料 全ての種類 関連順 詳細リスト ハッピーキャンパス


食品科学実験 5 水の硬度と味 毎日レポート
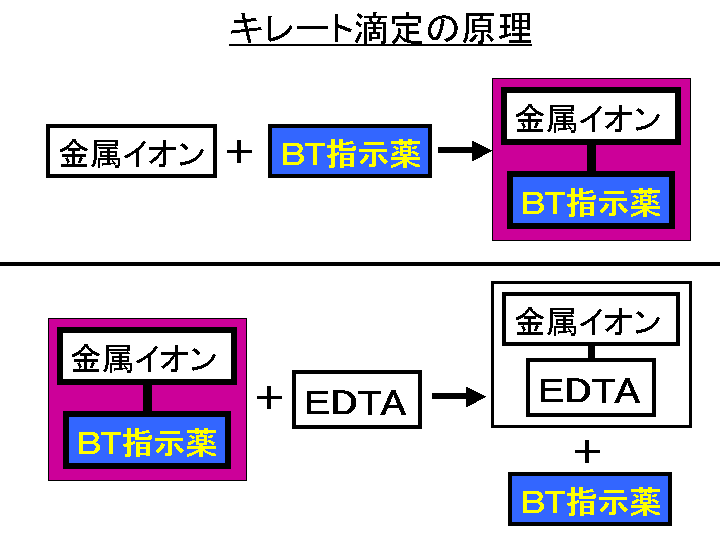


水の硬度測定 キレート滴定



キレート錯体の物性とその利用



大学の 水の分析実験 なんとなく実験しています



0 件のコメント:
コメントを投稿